Após Reino Unido, EUA liberam técnica inovadora para edição do DNA
Método laureado com Nobel em 2020 foi aprovado para pacientes com doença falciforme acima de 12 anos; preço é gargalo

Os Estados Unidos se tornaram nesta sexta-feira, 8, o segundo lugar do mundo a aprovar a terapia inovadora CRISPR-Cas9 para pessoas com doença falciforme, condição hematológica que causa fortes dores e pode levar à morte. Conhecido como “tesouras genéticas”, o tratamento de edição precisa do DNA foi liberado no mês passado no Reino Unido e, 2020, recebeu o Prêmio Nobel de Química.
A liberação concedida pela Food and Drug Administration (FDA) foi para o tratamento Casgevy. Na ocasião, também foi aprovada a terapia baseada em vetor viral Lyfgenia. Ambos os métodos utilizam células-tronco dos próprios pacientes e são indicados para pessoas com 12 anos ou mais.
“As terapias genéticas carregam a promessa de oferecer tratamentos mais efetivos e direcionados aos alvos especialmente para indivíduos com doenças raras, que têm opções limitadas de tratamento”, disse, em comunicado, Nicole Verdun, diretora do escritório de Produtos Terapêuticos do Centro de Avaliação Biológica e Pesquisa da FDA.
O geneticista Salmo Raskin, presidente do Genetika Laboratórios, diz que o uso da terapia é um avanço para o tratamento da doença falciforme. “É um procedimento que envolve um transplante de medula, mas do próprio paciente. O tratamento atual já usa, só que de um doador e, em 80% dos casos, ele não é compatível.”
Segundo Raskin, a terapia é eficaz na correção do problema. “O organismo começa a produzir hemoglobinas que funcionam bem, visto que a doença faz com que as elas não carreguem oxigênio corretamente para as células.”
O preço do tratamento é um gargalo. Segundo um artigo publicado no periódico científico Nature, o valor final da terapia é estimado em 2 milhões de dólares, algo perto de 10 milhões de reais, por pessoa.
“Isso torna a recém-aprovada terapia para anemia falciforme um caso emblemático: apesar de seu potencial, seu alto custo pode limitar quem pode se beneficiar dela. Mais do que nunca é a hora de a comunidade científica se voltar a buscar inovações para redução do custo e ampliar o acesso”, afirma Bruno Solano, médico especialista em terapia celular e pesquisador da Ciência Pioneira.
Ao lado de pesquisadores do Innovative Genomics Institute – organização fundada pela vencedora do Nobel Jennifer Doudna – , Solano está trabalhando para desenvolver alternativas mais acessíveis. “Temos avançado bastante para modificar o processo de produção destas células modificadas geneticamente no laboratório, tornando-o mais simples e de menor custo.”
Doença falciforme no Brasil
Em outubro, o Ministério da Saúde apresentou, pela primeira vez, uma panorama sobre a doença falciforme, condição genética que afeta principalmente a população preta e parda. São estimados 60 mil a 100 mil casos no país e foi estabelecido que a doença é de notificação compulsória.
Detectada pelo teste do pezinho, teve incidência de um caso a cada 2,5 mil nascidos vivos entre 2014 e 2020. A mortalidade por doença falciforme foi de 0,22 a cada 100 mil habitantes, especialmente na população de 20 a 29 anos.
Também chamada de anemia falciforme, ela se caracteriza por uma mutação no gene que produz a hemoglobina, resultando em glóbulos vermelhos do sangue (hemácias) em formato de foice ou meia lua, quando deveriam ser redondos. Pessoas com esse quadro podem ter anemia, crises de dor, má circulação e complicações renais.
O que é CRISPR?
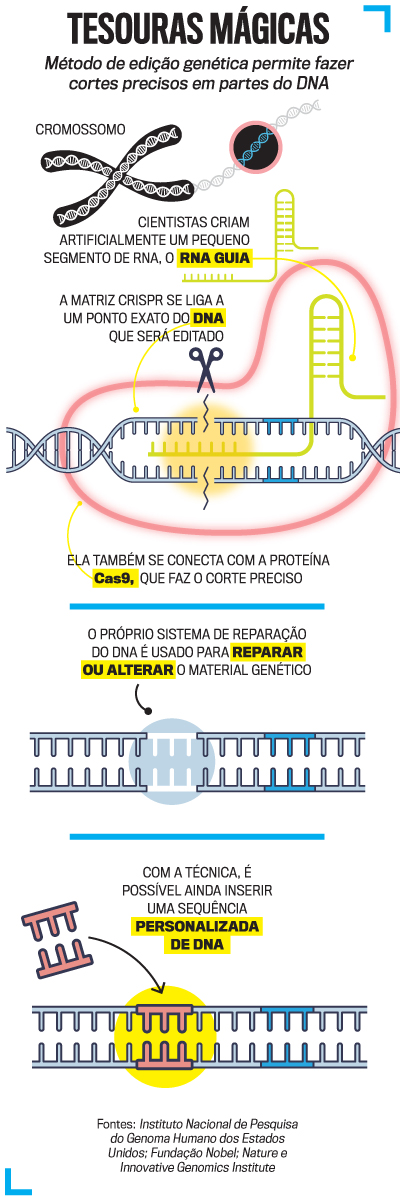
O CRISPR é fruto de anos de estudos envolvendo pesquisadores de vários campos da química e da biologia, mas dois nomes foram cruciais para a inovação ter aplicação prática e clínica: a francesa Emmanuelle Charpentier e a americana Jennifer Doudna, não à toa consagradas pela Academia Sueca em 2020. A dupla de cientistas investigou um comportamento um tanto interessante da bactéria Streptococcus pyogenes, que causa uma simples amigdalite mas também pode levar a uma infecção generalizada.
Ao se defender do ataque de um vírus, esses microrganismos capturam pequenas partes do genoma viral e as guardam no próprio DNA — eis o que se batizou de matriz CRISPR. Quando vem um novo bombardeio virológico, as bactérias já são capazes de se lembrar da sequência e tal matriz se conecta aos genes do invasor.
Entra em ação, nesse ponto, uma enzima, a Cas9, que picota o DNA viral e o inativa. Esse mecanismo natural foi a fonte de inspiração para a técnica que ganhou o apelido de “tesouras genéticas”: por meio de um corte preciso, ela permite interferir em sequências de qualquer DNA, incluindo o humano.


 SEGUIR
SEGUIR
 SEGUINDO
SEGUINDO




















